
冻存通常是指将细胞冷冻储存在-196℃的液氮中。如在不加任何保护剂的情况下,直接对细胞加以冻存,会导致细胞内、外的水分迅速形成冰晶,进而对细胞结构与功能造成一系列的损害,如机械损伤、蛋白质变性、电解质升高等,最后可引起细胞死亡。为了避免细胞内冰晶的形成,在冻存细胞时常向培养液中加入适量的二甲亚砜(DMSO),因其相对分子质量较小而溶解度大,较易穿透进入细胞中,使细胞内冰点下降,并可提高细胞膜对水的通透性,配合以缓慢冷冻的方法,可使细胞内的水分逐步地渗透出胞外,避免了冰晶在细胞内大量的形成。
复苏是指将冻存的细胞从-196℃的液氮中取出融解,使其活力恢复的过程。快速融化的手段可以保证细胞外结晶在很短时间内融化,避免由于缓慢融化使水分渗入细胞重新结晶对细胞造成损害。复苏成功的细胞可以保持很高的活力。

细胞的冻存:
1.用0.25%胰蛋白酶溶液消化处于对数生长期的单层培养细胞,收集消化的细胞于15mL离心管中;
2.800-1000rpm离心5min,弃上清;
3.加入适量冻存液(百澳博无DMSO细胞冻存液),用吸管吹打细胞制悬,调整细胞密度为5×106-1×107个/mL;
4.每个冻存管分装细胞悬液1mL,旋紧冻存管的盖;
5.在冻存管上标明细胞的名称、冻存时间、冻存人名等;
6.将冻存管置于如下条件下逐步加以冻存:-80℃,12h→液氮;
7.若使用含10%DMSO和10%FBS的培养液冻存细胞,则将冻存管置于如下条件下逐步加以冻存:4℃,1h→-20℃,2h→-80℃,12h→液氮。
细胞复苏和活率测定:
1.用止血钳从液氮罐冻存盒中取出细胞冻存管1只,迅速将其置入37℃水浴中,不断摇动使冻存的细胞悬液尽快融化;
2.用酒精棉球擦拭冻存管,放入超净工作台中;
3.将已融化的细胞悬液用吸管移入离心管中,加10倍体积的RPMI 1640培养基(含10%小牛血清),吹打混匀;
4.800-1000rpm离心5min,弃上清液;
5.加入培养液吹打沉淀的细胞,使其悬浮,将细胞悬液与0.4%的台盼蓝溶液以9:1的比例混合。在室温下染色3-5分钟,对细胞进行计数,计算活细胞比例;
6.按1×105个mL的细胞浓度,将细胞接种在培养瓶中,置于培养箱中培养;
7.24h后取出培养瓶,观察细胞生长状况。

注意事项:
1.对数期的细胞增殖能力强,冻存后生存率较高,因此,在进行细胞冻存时,应尽量选择处于此期的细胞加以冻存;
2.为了保证冻存的质量及复苏后细胞的存活率,冻存时应掌握好消化时间,消化过度将对细胞造成损伤,复苏时细胞难于存活。此外,复苏后接种时,细胞的浓度不能太低,最好控制在1×105-5×105个/mL,这样才能保证复苏成功;
3.冻存管的管盖应封盖严密,以免复苏时细胞外溢;
4.复苏时,从液氮取出冻存管到水浴中融化的过程要快,否则将会导致冰晶的形成,伤害细胞。同时,一次复苏的冻存管数量不要太多,否则会引起水浴锅中传热不佳,延缓冻存的细胞悬液融化的时间;
5.为防止液氮冻伤,在复苏过程中应戴上棉质手套。
细胞增殖情况:
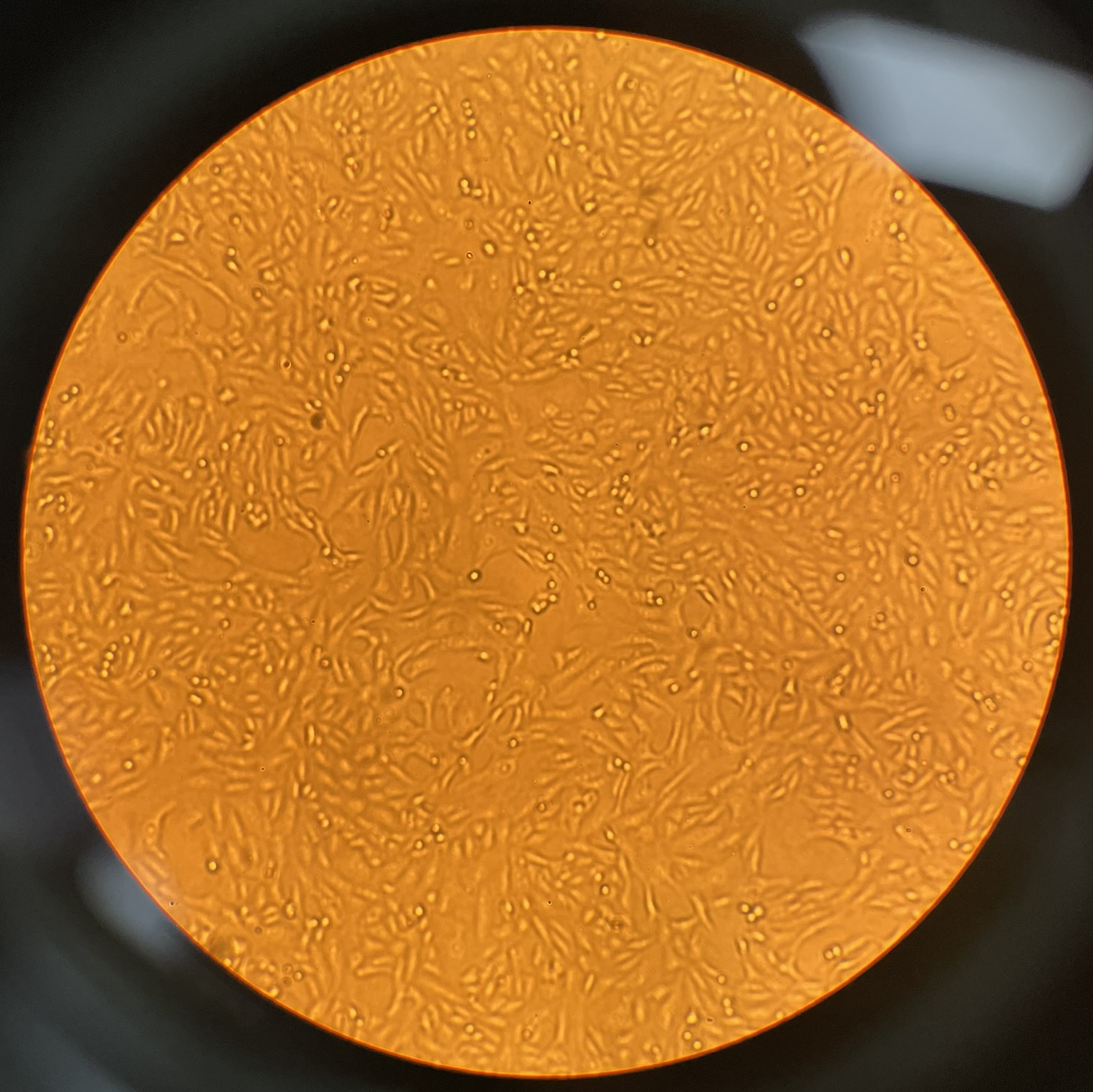
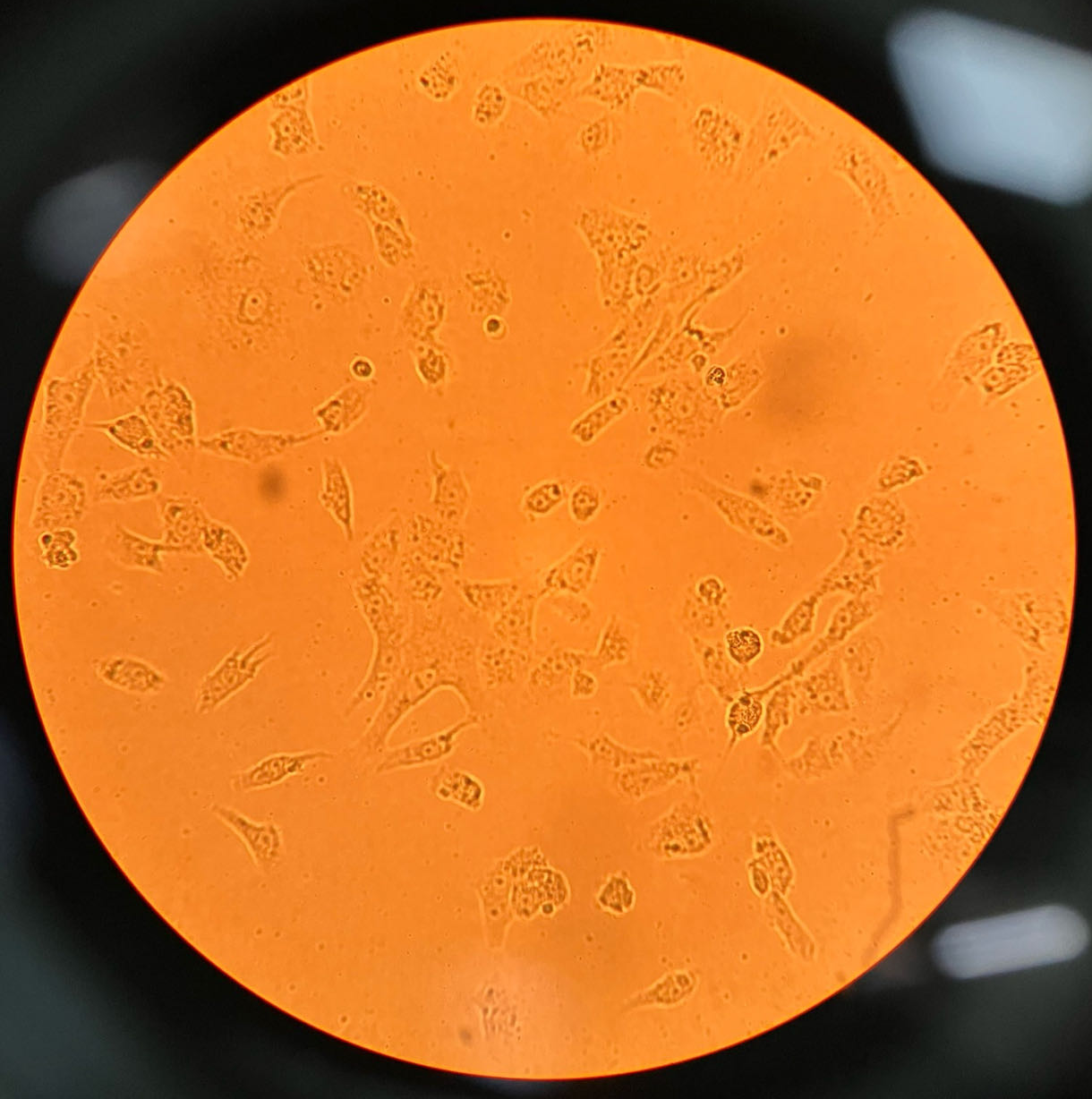
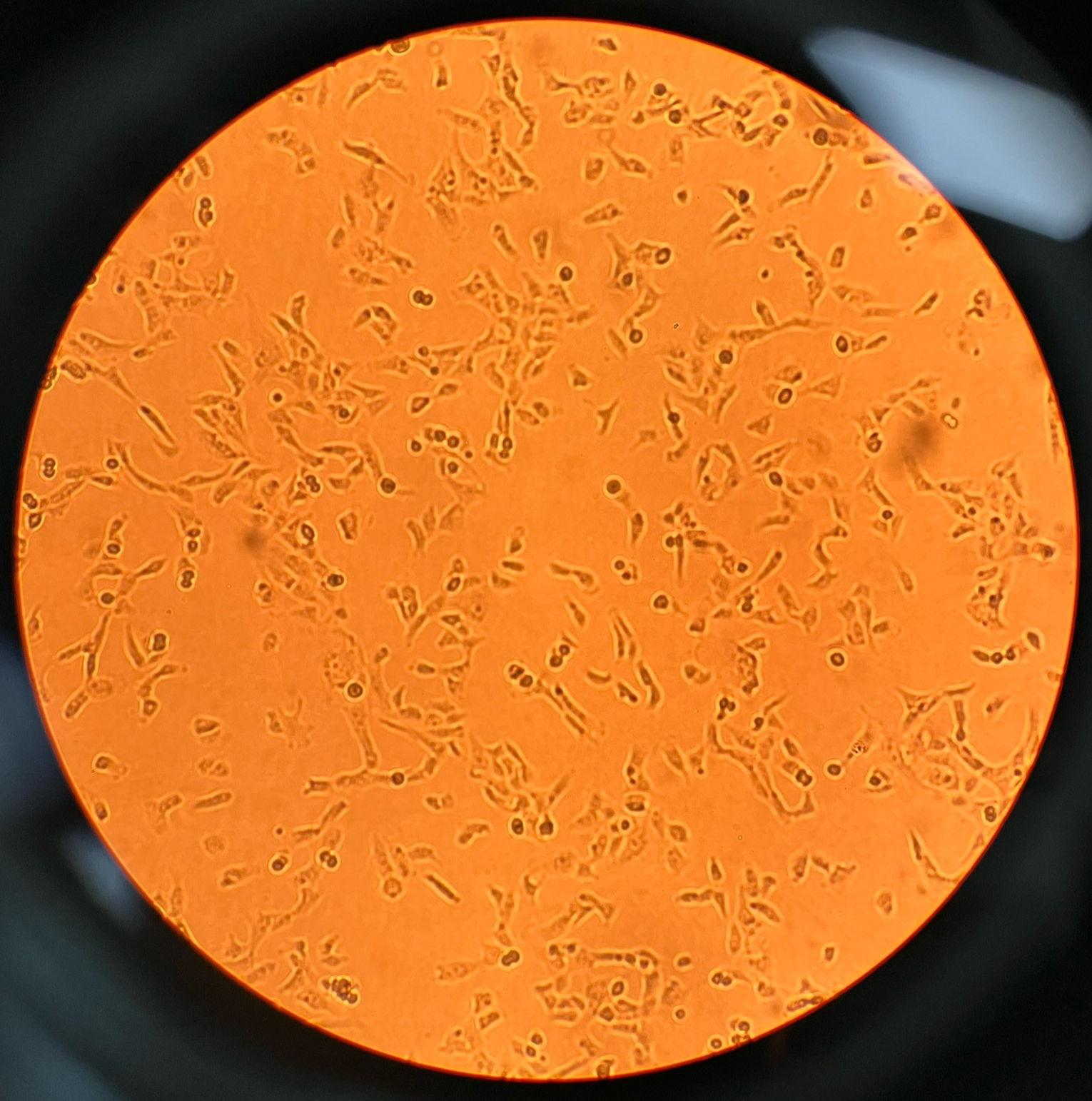
24h贴壁状态 48h增殖情况 72h增殖情况(细胞汇合度达90%)
|
上一条:使用指南--细胞培养耗材
下一条:实验小知识--如何进行正确的细胞计数实验? |
返回列表 |