
蛋白质的制备和储存是诸多实验方法中至关重要的一步,包括分子生物学、蛋白质组学、法医学和生物制药等使用的各种方法。这些方法中蛋白质样品的纯度和产率对实验结果有很大影响,这取决于原料的质量、制备和处理方法,也取决于制备和储存过程中使用的条件和耗材[1]。
01. 概述
蛋白质分子或多肽在实验室耗材聚合物表面的非特异性吸附已被证明是导致样品在储存/处理期间损失和影响实验结果的重要因素[2,3,4]。这一过程主要是通过多肽和蛋白质中的疏水结构与疏水聚合物表面的非特异性结合来传递的(图1A),导致结构变性和浓度在相对较短的时间内降低,高达50%的蛋白质样品可能在24小时内被吸附(图3)。非特异性的样品和活性损失可能是影响实验结果的关键因素,特别是在蛋白质组学、法医学或其他实验中测定微量或痕量样品时影响尤为显著。
早期的一些国外实验室耗材制造商通过各种材料改性来解决这个问题。最常见的方法是涂层(硅化),其目的是在蛋白质和聚合物表面之间形成屏障,减少结合。然而,根据实验条件的不同,涂层可能不够稳定并迁移到样品中(浸出),这可能对样品纯度和实验结果产生不利影响[5.6]。
另一种方法使用低残留表面改性,这减少了样品处理步骤中液体的残留,但本身不会导致分子水平上的吸附减少。
第三种方法是直接优化材料,其疏水性降低(国外厂家A),导致蛋白质分子在耗材表面的吸附减少(图1B)。这三种方法依赖于不同的分子机制,并允许不同程度的蛋白质样品吸附还原。
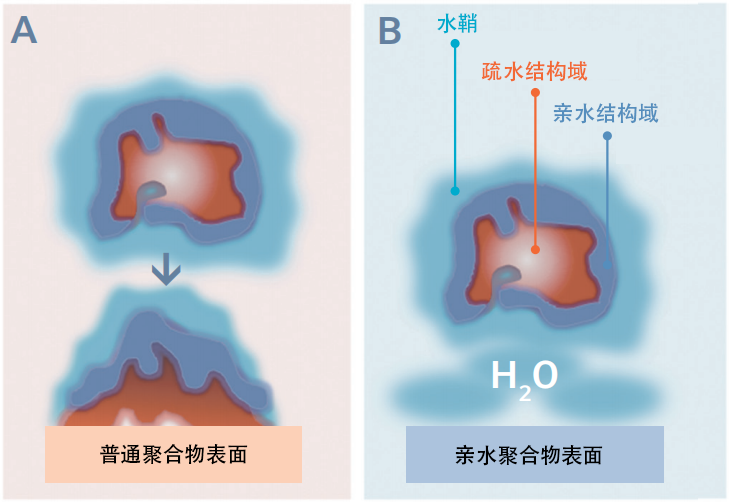
图1: A) 蛋白质分子通过疏水结构域与普通聚合物表面结合。导致蛋白质结构变性和活性/浓度损失。B)亲水聚合物表面与水分子通过氢键或偶极-偶极相互作用,使表面被浸润,避免了蛋白质与聚合物表面通过疏水相互作用结合而造成结构变性和活性/浓度损失。
02. 实验分析
聚立1.5mL低蛋白吸附离心管采用特殊的表面处理技术以达到低蛋白吸附的效果。
以下通过使用高灵敏度的荧光测定法研究了FITC-BSA样品的非特异性结合,比较了不同厂家的1.5mL低吸附离心管的蛋白回收率。
1)材料和方法
采用荧光标记蛋白法评估蛋白质回收率:分别将220µL的FITC-BSA溶液(1µg/mL,1×PBS)加入不同制造商的1.5mL低蛋白吸附离心管中,室温下避光孵育24小时。孵育后,将每个离心管中的残液转移200µL至黑色96孔板中,使用Varioskan ALF™微孔板荧光酶标仪(Thermo Fisher Scientific®)进行荧光测量。采用FITC-BSA标准溶液的校准曲线(图2)计算样品中FITC-BSA的回收率。同时以普通1.5mL聚丙烯离心管作为阴性对照。所有样品均做了4组或以上重复。
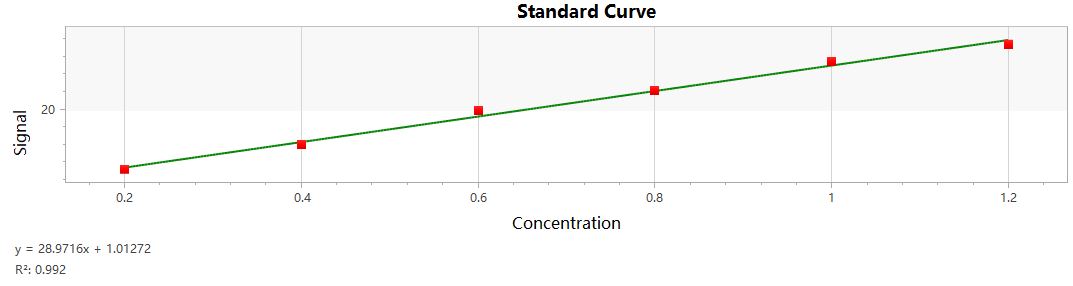
图2 FITC-BSA标准曲线
2)结果和讨论
FITC-BSA样品在不同离心管中孵育后的回收率如图3所示。这表明,不同低蛋白吸附离心管与普通聚丙烯离心管相比,蛋白质的回收率均有明显的优势,且通过特殊表面处理法实现低吸附的聚立离心管比通过降低疏水性的直接优化材料的方法达到该目的国外厂家A的离心管蛋白质回收率提高了10%以上。
因此使用聚立低蛋白吸附离心管可确保蛋白质样品的安全保护,从而获得更稳定和可靠的实验结果。
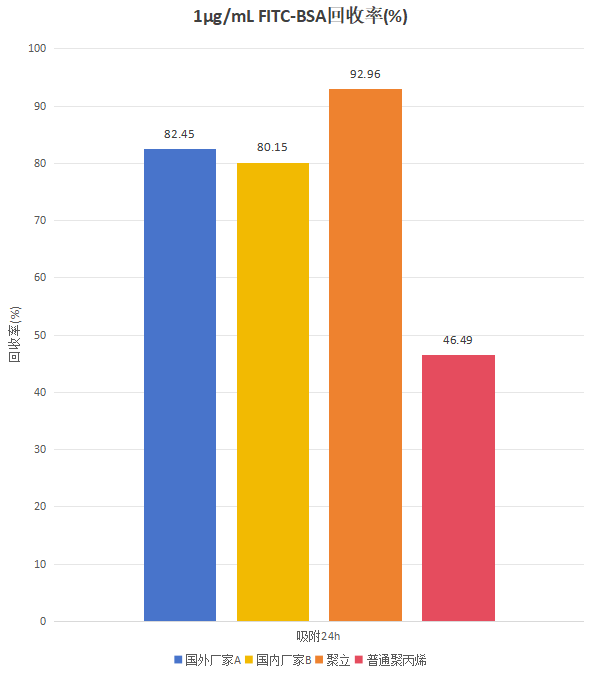
图3 FITC-BSA在不同离心管中的24h回收率
3)参考文献
[1] Goebel-Stengel M, Stengel A, Taché Y, Reeve JR. The importance of using the optimal plastic and glassware in studies involving peptides. Analytical Biochemistry 2011; 414(1):38-46.
[2] Kristensen K, Henriksen JR, Andresen TL. Adsorption of cationic peptides to solid surfaces of glass and plastic. PLoS One 2015; 10(5).
[3] Hoofnagle AN, Whiteaker JR, Carr SA, Kuhn E, Liu T, Massoni SA, Thomas SN, Townsend RR et al. Recommendations for the Generation, Quantification, Storage, and Handling of Peptides Used for Mass Spectrometry-Based Assays. Clin Chem 2016; 62(1):48-69.
[4] Kraut A, Marcellin M, Adrait A, Kuhn L, Louwagie M, Kieffer-Jaquinod S, Lebert D, Masselon CD, Dupuis A, Bruley C, Jaquinod M, Garin J, Gallagher-Gambarelli M. Peptide storage: are you getting the best return on your investment? Defining optimal storage conditions for proteomics samples. J Proteome Res 2009; 7:3778-85.
[5] Smith C. Selecting the Right Tubes or Plates for Your Research. Biocompare 2011; Nov. 9.
[6] Bowen RAR, Remaley AT. Interferences from blood collection tube components on clinical chemistry assays. Biochem. Med. 2014; 24: 31-44.
|
上一条:钜惠价--15/50ml离心管福利大派送
下一条:提取的RNA总是降解?问题可能出在耗材上 |
返回列表 |